耐药癫痫动物模型的研究进展_《癫痫杂志》
癫痫是神经系统常见的慢性疾病之一, 其以异常放电的脑神经元的引起的短暂大脑功能障碍为特征, 全世界约有多达7 000 万人受其影响。虽然常规抗癫痫发作药物(Anti-seizure medications,ASMs)可以控制大部分患者的癫痫发作,但仍有大约30%的患者对药物不耐受。不耐受患者中仅少于1%会选择手术治疗,绝大多数依然期待药物治疗。耐药癫痫会增加患者的身心负担而且还可能导致患者认知功能受损甚至猝死。耐药癫痫模型的开发应该跟疾病的病理过程息息相关,以此更好的模拟疾病的发生发展过程,进而为干预疾病打下正确的现实基础。根据患者对ASMs的动态反应,国外有学者认为耐药癫痫动物模型可以被定义为反复的惊厥发作对单用药物治疗不反应或反应弱,同时用到两种及以上最大可耐受剂量的ASMs。癫痫耐药是一个亟待解决的问题,选择正确的动物模型有助于研究的进一步展开。多种耐药癫痫模型如表1所示,并给予补充说明如下。
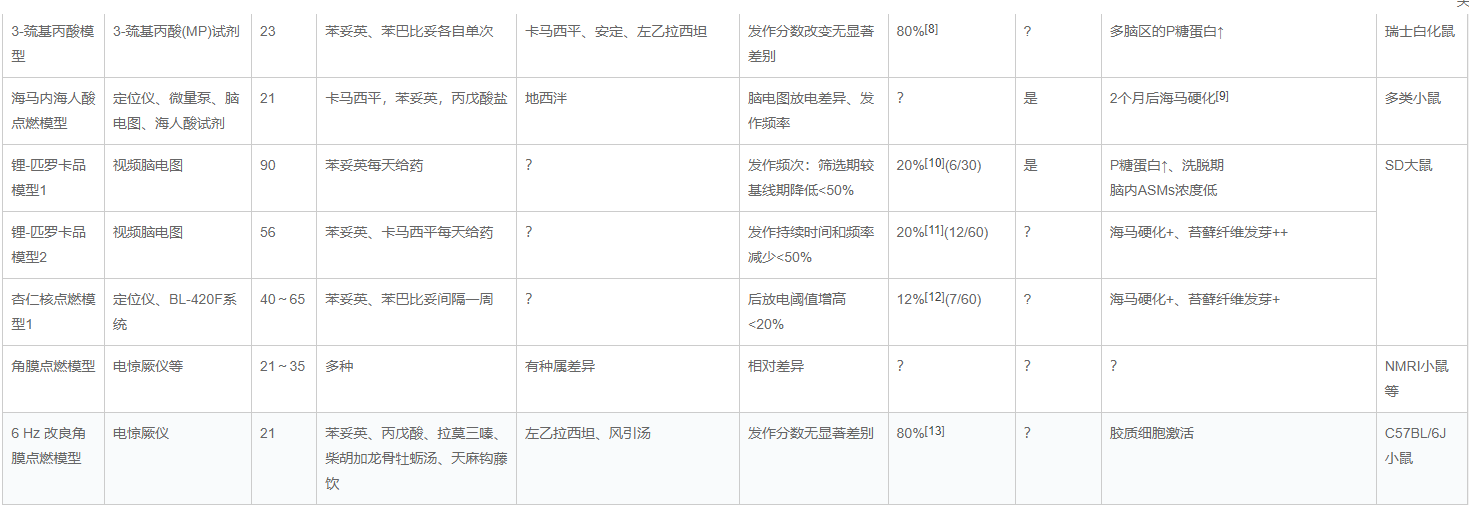
表1 多种耐药癫痫模型的对照表
1 3-巯基丙酸模型
3-巯基丙酸(3-mercaptopropionic acid,MP)模型最先被Enrique等学者建立报道,旨在建立一个耐药筛选模型,连续23天,每天一次腹腔注射给药,通过给予MP抑制抑制性神经递质γ-氨基丁酸(Gamma-aminobutyric acid,GABA)的合成,导致瑞士白化小鼠兴奋性痫性发作的原理来实现。该模型简称为MP23模型,具有简易的优势,具有潜在的推广应用价值。该模型在构建过程中第19天,小鼠的痫性发作分数为4.33±0.02,第23天变为5.66±0.02(P<0.05)。该模型于第24天检测耐药性,发现对苯妥英钠有极高的耐药性为100%,对苯巴比妥耐药率为80%。在造模过程中总的死亡率为20%。该模型报道小鼠的耐药特性在造模完成后至少7天内保持稳定。在具有耐药特性的小鼠取脑区组织免疫组织化学染色发现P糖蛋白(P-gp;Mdr1)的高表达。在大脑皮层、海马和纹状体都可以见P糖蛋白的表达升高。P糖蛋白属于ATP依赖的外排转运体超家族中的一种膜蛋白,如今有研究证实了某些ASMs是作为P糖蛋白的底物而存在的,也有研究表明,血脑屏障上ATP依赖的外排转运体的底物经静脉给药于大鼠时,可见脑组织间液和脑脊液里药物浓度比血浆低,也有实验证明对于P糖蛋白的底物药物,在 Mdr1a(-/-) 大鼠脑脊液的药物浓度比野生型大鼠的高。这些结果表明,耐药癫痫中P糖蛋白的表达上调可能加重了药物抵抗。
2 海马海人酸模型
海马海人酸模型是通过单次在立体定位仪下海马内注射海人酸,Baraban等报道,大多数小鼠在注射后可诱发癫痫持续状态,之后发生高度频繁的脑电图性癫痫发作和较少的惊厥发作。Riban等在2002年报道了该模型的从海马记录的脑电图痫性发作对主要的ASMs(如卡马西平、苯妥英和丙戊酸盐)具有抗药性,而地西泮可以抑制这些局灶性脑电图痫性发作。由于该模型为自发性慢性癫痫模型,再加上海马内放电的高复发,ASMs极易地在ASMs注射后1~2 h内进行测试,也可在慢性治疗期间进行测试,因此Guillemain等在2012年提议该模型适合作为难以治疗的局灶性癫痫发作的模型。
近年来,海马内测海人酸模型在NMRI、瑞士、C57BL/6或FVB/N小鼠均有研究,Klein等在2015年构建了这个模型,并检查了FVB/N癫痫小鼠对ASMs的个体反应,在ASMs注射后2 h内监测视频脑电,发现局灶性非惊厥性癫痫发作对卡马西平和苯妥英有抗药性,而丙戊酸盐和左乙拉西坦具有中度、苯巴比妥和地西泮具有显著的抗癫痫作用。而参与测试的这6种ASMs似乎都抑制了全身性抽搐发作。
3 锂-匹罗卡品模型
该模型给予SD大鼠腹腔注射匹罗卡品让其出现Ⅳ级及以上癫痫持续发作90 min后用10 mg/kg地西泮终止发作,将 14 d 后有自发性癫痫发作的大鼠视为造模成功,在其右侧杏仁核植入电极监测脑电图。模型制作成功后记录大鼠癫性发作频率、持续时间和发作级别。2 周后开始行耐药筛选,同时腹腔注射苯巴比妥(Phenobarbital,PB),30 mg/kg,2 次/d,给药过程共持续2周并记录癫痫发作次数和脑电图较之前的变化,用PB后癫痫发作持续时间和发作频率减少>50% 的为药物敏感的大鼠,反之则为耐PB的大鼠。后面继续用卡马西平(Carbamazepine,CBZ)进行类似筛选,判断方法同上,对PB和CBZ均耐药者纳入耐药组。
按许兰等的建立方法,60只SD大鼠参与造模,44只完成造模过程,癫痫发作29只,最终筛选出符合耐药条件的12只,耐药率12/29=41%。此种模型的病理改变如表1所述,同时具有模型稳定的特点。
也有学者用锂-匹罗卡品制作耐苯妥英钠的SD大鼠耐药癫痫模型,监测视频脑电,46~60 d为基线期,61~75 d为筛选期,筛选期间给予苯妥英钠(2次/d),76~90 d为苯妥英钠洗脱期。根据苯妥英钠给药前后癫痫频次变化筛选出苯妥英钠耐药模型(筛选期发作频次较基线期降低<50%),余为苯妥英钠不耐药模型鼠。
4 杏仁核点燃模型
杏仁核点燃模型被唐太峰等探索过,每日予SD大鼠杏仁核1次电刺激,连续3次4~5级全面发作视为点燃成功,于第二天记录后发放电位阈值(After discharge threshold,ADT),即引起大鼠全面发作所需的最小电流强度。再进行耐药筛选,当给予ASMs后,ADT值与未用药时相比增加不超过20%视为耐药癫痫鼠。1次/周,先用苯妥英钠筛选,筛选期3周,再用同样方法用PB筛选,最终满足对两种药物耐药即表示此模型的造模成功。
该模型的建立需要立体定位仪,BL-420F生物机能系统等设备,在唐太峰等学者的研究中,该模型成功点燃需要3~30 d,在点燃过程中,除去死亡和电极脱落的数量,点燃成功率为24/47(51%),最终通过耐药筛选出7只(7/24=29%)耐药癫痫模型。该模型具有稳定的优点,又符合临床上对耐药癫痫的定义,能较好地模拟癫痫的病理改变。有学者就把杏仁核点燃模型和锂-匹罗卡品模型两种耐药癫痫模型的大鼠海马区的病理改变做了一次比较,发现两者在海马神经元坏死方面无明显差异,但匹罗卡品敏感组和耐药组的苔藓纤维发芽均较杏仁核模型明显加重。但关于苔藓纤维发芽是否促进癫痫发生,不同学者对此持不同意见。
5 角膜点燃模型
6 Hz模型通过角膜电刺激造模,于上世纪50年代提出,由于该模型在癫痫发作形式和脑电图模式上与精神运动性癫痫在临床发生是的表现相似,Toman 等将其作为精神运动性癫痫发作模型。近10年来,6 Hz模型已更多地应用于ASMs筛选。6 Hz模型小鼠有异常的行为表型,小鼠极度活跃,不会产生类似焦虑的行为,但快感缺失,有社交障碍,学习和记忆能力也受到严重损害。因此,6 Hz模型可被用来研究癫痫的严重并发症,其致痫机制的文献在近5年比较多。6 Hz模型制作简单,周期短,点燃后脑内异常痫性放电持续时间长。与化学点燃模型相比,电点燃可避免外来物质的相互作用对后续实验的影响,并且有助于发作阈值的测定。但是,6 Hz模型作为一种急性模型,不能很好的模拟耐药癫痫形成过程中的神经网络和神经细胞的改变。慢性癫痫发作的模型也往往是高度劳动强度和资源密集型的,因此不适合于早期评估大规模化学库的中等至高等通量药物发现。
60 Hz角膜点燃模型(Corneally kindled model,CKM)是一种中等通量的继发性局灶性惊厥模型,在技术上可行且危害小。该模型经常用于前线药物评估,尽管最小的药物抵抗但表现出与海马点燃的大鼠相一致的药理学变化。2015年美国国家神经疾病和卒中研究所癫痫治疗筛查计划甚至将60 Hz CKM优先用于初步鉴定抗惊厥效果并可反复评估。此外,60 Hz CKM表现出行为共存病和病理生理学改变,例如记忆缺陷和星形胶质细胞增生。近4年有Koneval Z等建立了耐拉莫三嗪60 Hz角膜快速点燃小鼠模型,于角膜刺激30 min前给予拉莫三嗪,每天两次直至点燃,判断标准为引发持续5级发作。然后隔一天刺激一次,而其他小鼠仍然2次/d直至点燃。该种拉莫三嗪耐药的角膜点燃模型也对卡马西平、瑞替加滨和丙戊酸耐药。
6 6Hz改良角膜点燃模型
该模型由浙江中医药大学陆美海等优化,是相对于其他小鼠品系的改良,采用8周龄C57BL/6J小鼠在电惊厥仪刺激下行角膜点燃(44 mA,0.2 ms,3 s,6 Hz), 连续3周,2次/d,两次间隔>4 h,可见颞叶胶质细胞增生的病理改变,该研究发现该模型对3种ASMs(苯妥英钠、丙戊酸钠、拉莫三嗪)和2种中药方剂(柴胡加龙骨牡蛎汤、天麻钩藤饮)存在一定耐药性。但中药风引汤却可以降低改良的6 Hz模型的发作级别和大发作概率。可见耐药癫痫模型仍然存在可控制发作的药物。
7 抗苯妥英钠杏仁核点燃模型
Goddard等学者提出了最原始的杏仁核点燃模型,在点燃模型中发现,局灶性癫痫发作阶段对ASMs的反应远低于继发的全身癫痫发作,跟临床上表现一致。后来有学者发现,被完全点燃的200多只大鼠的平均数据显示对苯妥英钠的敏感性分为三种:16%对苯妥英钠(或其前药福苯妥英钠)有一致的抗癫痫反应、23%无抗癫痫反应、61%有不同的反应。其中无抗癫痫反应的一组被认为是代表了临床上药物难治性癫痫。Löscher等曾发现除左乙拉西坦外,所有被检测的ASMs在苯妥英钠无反应者中显著降低或根本无效,这表明点燃的Wistar大鼠的苯妥英钠耐药可扩展到其他ASMs。Töllner等证明耐苯妥英钠杏仁核点燃大鼠中丙戊酸盐抗癫痫反应与其对黑质网状结构(Substantia Nigra Pars Reticulata,SNr)GABA能神经元放电频率和模式的影响存在相关性。黑质网状结构是一个主要的基底神经节输出结构,涉及癫痫的传播,癫痫控制,和癫痫诱导的神经可塑性。这些数据证明了SNr参与了药物抵抗性癫痫,并强调了基底神经节作为新的治疗选择的靶结构的相关性。
8 抗苯巴比妥杏仁核点燃模型
该种模型通过电刺激基底外侧杏仁核,约在1个月后产生慢性自发性癫痫模型,在此模型上进行视频脑电监测,给予最大耐受剂量的PB,历经基线期(给药前2周),干预期(2周),洗脱期(2周),再根据给药前后癫痫发作频率差异判断大鼠对PB是否反应,发作持续时间和频率减少<50%可以认为对PB耐药。在Brandt等的三项独立的前瞻性研究中,约40%的大鼠对PB的治疗具有耐药性,证明了该模型的重现性。其中一项研究表明对PB耐药的大鼠有83%的概率也对苯妥英钠耐药。也有研究表明,PB-无应答者的平均发作频率显著高于应答者,这与临床经验一致,即癫痫早期发作频率是预测难治性的主要危险因素之一。然而,对治疗的抗药性也发生在与应答者在发作频率上无差异的大鼠身上,这表明仅疾病严重程度不足以解释ASMs耐药性。除了平均发作频率的差异外,Gastens等还发现PB-无应答者在行为和认知改变方面与应答者不同。此外,大多数(90%)的PB-无反应答者表现出海马损伤,而这种损伤仅在7%的应答者中确定,因此海马神经元丢失,特别是在齿状回中,是PB耐药大鼠的一个特征。同样,Löscher等在大鼠模型中的这些观察与临床经验是一致的,因为精神疾病和海马硬化症是ASMs抵抗的预测因子。除了海马损伤外,PB-无应答者与应答者相比,在癫痫灶中外排转运体P-gp的脑表达增加。 此外,GABAA受体的亚基表达和结合特性在无应答者中发生了改变,这可能与PB耐药有关,因为这种药物主要作用于GABAA受体。由此可见,PB耐药大鼠模型对于新药的筛选或有目标的耐药机制假设验证具有较好地适应性。
9 抗拉莫三嗪杏仁核点燃模型
抗拉莫三嗪杏仁核点燃模型是通过在杏仁核电刺激前给予低剂量的拉莫三嗪,从而产生对拉莫三嗪甚至其他ASMs的药物抵抗。此种模型被美国用到癫痫治疗筛查方案中。2019年Metcalf等用这种模型测试了一系列ASMs,最后得出五种钠通道阻滞剂(醋酸艾司利卡西平、拉科酰胺、拉莫三嗪、苯妥英钠和卢非酰胺)在本模型中要么无效,要么不耐受的剂量下有效。相反,针对GABA受体(氯巴占、氯硝西泮、PB)或GABA摄取蛋白(噻加宾)的药物对惊厥发作具有剂量依赖性的疗效。作用于调节Ca2+通道的药物表现出差异活性:乙琥胺无效,而加巴喷丁则中等有效。依佐加滨和丙戊酸盐也是高度有效的,而托吡酯和左乙拉西坦在试验剂量下无效。
该模型使用的是SD大鼠,每天接受腹腔注射拉莫三嗪(5 mg/kg,0.04 mL/10g)。在拉莫三嗪给药后1 h,动物通过拴系电极(塑料)连接到Biopac MP100系统,给予阈下电刺激200 μA,50 Hz,2 s(5 d/周,3~4周),记录基线和刺激后脑电图(Electroencephalogram,EEG)。直到大鼠发生4分及以上发作连续4次或5次即可认为全面点燃。两天后,给予大鼠拉莫三嗪(30 mg/kg,静脉注射)进行耐药筛选。在电刺激前给予ASMs,根据癫痫发作分数和后发放电位持续时间与之前比较有无显著性差异来判断耐药与否。在参与实验的大鼠行为发作按Racine量表评分,行为发作评分为0~2的动物被认为是“受保护的”。
10 小结与展望
综上,以上模型都存在一个共性—所有模型的耐药表现为至少对两种ASMs抵抗,其中对钠离子通道阻滞剂耐药有高重复率。病理改变以P-gp的高表达具有高重复率。6 Hz点燃模型和MP23模型为造模和监测相对简单的急性癫痫发作模型,其余为成功率相对低的高强度劳动和资金密集型的慢性癫痫发作模型。虽然如今存在这么多可供选择的耐药癫痫动物模型,但是以上任何一种动物模型,除了疾病的某方面都不能完全复制人体的疾病过程。在今后的科研过程中,从各类模型中根据现有条件和需求选择合适的、能够说明问题的模型是一门学问。尽管新药的开发达到了20多种,但癫痫耐药率几乎一直持续在30%左右,有待改善,这就不得不值得反思,致力于耐药机制的研究和新药的开发,需要思考临床前研究有无缺陷,其中动物模型的使用和结果对于填补临床转化的空白至关重要。此外,模型的选择亦或构建是关键,可以为今后的耐药机制和新药开发提供有效借鉴。
上一篇 : 耐药性癫痫的研究进展_《癫痫杂志》_唯一官网
下一篇 : 癫痫发作的报警与预警_《癫痫杂志》
备案号:渝ICP备2022007412号-1

