从病例看“自身免疫(相关)性癫痫” 在临床诊治中的挑战
随着人们对脑炎的自身免疫性病因不断深入了解,自身免疫性脑炎(Autoimmune encephalitis)已被越来越多临床医生认识和接受。在此背景下,癫痫领域也相应提出了“自身免疫性癫痫(Autoimmune epilepsy)”这一概念。尤其值得关注的是,2017年国际抗癫痫联盟(International League Against Epilepsy,ILAE)在最新的六大癫痫病因分类中,单独列出了一种“免疫性”病因,初衷是希望临床医生对尽早发现免疫病因并尽早启动免疫治疗予以重视。然而,由于在相关概念层面上仍存在定义模糊、认识不统一的情况,给临床实践带来一定程度的混乱,甚至造成诊断和治疗的“泛化、过度化”。本文通过回顾性分析3例临床病例的诊断、治疗及近期随访资料,来探讨目前国内存在的某种程度上诊疗“扩大化”的问题并分析其成因,以引起临床医生的注意。同时,通过结合工作经验和相关文献复习,来探讨解决之道。
1 临床资料
回顾3例代表性病例的诊治及随访资料,总结如下:
例1 男,39岁。于2019年12月因“发作性‘朦胧状态’近2年,反复抽搐3月余”来我院就诊。患者主诉约2年前开始发作性进入“朦胧状态”(“做梦样”),发作时心里明白,可听到旁人讲话,但无法理解内容,自己也不能言语,每次发作持续1~2 min,发作3~5次/月。当地曾行头部磁共振成像(Magnetic resonance imaging,MRI)及脑电图(Electroencephalogram,EEG)检查均正常。未予诊断、治疗。近3个月开始出现全身抽搐伴意识丧失,每次发作约2~3 min,共发作2次。于当地上级医院复查头部MRI仍正常,EEG示:双侧前头部稍多theta慢波。当地行腰穿检查:压力正常范围,脑脊液常规、生化、细胞学、病原学筛查均阴性,并先后两次血清及一次脑脊液送检自身免疫性抗体筛查,结果均为阴性。起病以来,发作间期如常,否认记忆减退、精神行为异常或睡眠障碍等。既往有高血压病5年。否认脑部疾病、免疫或肿瘤性疾病史。入院查体未见明确异常。我院复查EEG示:左颞额少量慢波,未见痫样放电。最终临床诊断为局灶性癫痫,颞叶癫痫可能性大,癫痫病因不明(隐源性)。给予奥卡西平 0.45 g,每日两次,随诊至今无发作。
例2 男,37岁。于2021年5月因“反复发作性愣神半年、全身抽搐2月余”就诊。患者约半年前开始发作性愣神,伴咂嘴动作,每次1~2 min,约2~3个月发作一次,未就诊。近2个月来,上诉发作后继发全身抽搐,每次数分钟,遂至当地医院行头部MRI及EEG检查,结果均未见异常,未予治疗。本次就诊前一天开始反复出现3次全身抽搐发作,每次5~10 min,发作间期神智不清,送至当地医院急诊。起病以来,发作间期如常,否认记忆减退、运动障碍、精神行为异常或睡眠障碍。10年前大片皮肤烧伤史(面部及胸腹部著)。否认脑炎、脑外伤及免疫性疾病史。无特殊家族史。本次因发作持续状态被送至当地急诊后,给予静脉泵入丙戊酸钠(Sodium valproate,VPA)及肌注苯巴比妥,发作停止,意识转清。复查头部MRI仍未见异常。之后将抗发作药物调整为VPA 1 g,每日两次+拉莫三嗪25 mg,每日两次+左乙拉西坦1 g,每日两次,逐渐减量苯巴比妥。入院后第二天再发全身抽搐,再次给予静脉泵入VPA,发作逐渐减少并最终停止,但患者意识持续不恢复(浅-中度昏迷),遂先后两次腰穿检查(相隔1周):脑脊液无色透明,压力正常,白细胞8×106/L(1次),生化正常。先后进行两次脑脊液和一次血清自身免疫性脑炎抗体筛查,结果均为阴性,脑脊液病原学二代测序无阳性发现。考虑“抗体阴性自身免疫性脑炎、自身免疫性癫痫”,给予静注人免疫球蛋白(5 d),后加用激素冲击(1 g/d,共3d),患者仍持续昏迷。再次复查头部MRI示:双侧脑叶弥漫性肿胀,T2相可见对称性双侧岛叶、颞叶内侧及扣带回为著片状高信号,上述改变在DWI为高信号,ADC为低信号。EEG示:双侧弥漫性的δ波,部分波形为三相波。结合MRI和EEG所见,考虑此时符合弥漫性脑病表现,随即检测血氨水平,结果为269.8 umol/L(参考值:9~33 umol/L)。上级医生追问药物治疗方案,发现抽搐复发后再次静脉使用VPA治疗期间,一直未停经鼻饲的口服药物,包括VPA 2 g/d。考虑VPA相关脑病,立即停用VPA,继续鼻饲拉莫三嗪和左乙拉西坦,并给予鼻饲乳果糖等降氨治疗。2天后患者意识转清,复查血氨降至53.4 umol/L。出院后2个月门诊随访,无癫痫发作(口服拉莫三嗪和左乙拉西坦)。最终诊断为:① 局灶性癫痫、颞叶癫痫可能性大,癫痫病因不明;② VPA相关高氨血症性脑病(解释入院期间再次抽搐发作控制后持续昏迷)。
例3 男,69岁。于2019年10月因“发作性愣神、抽搐1年半”来我院就诊。患者自2018年5月开始发作性“脑子空白”感,数秒即过。不久出现反复愣神发作,有时伴双手摸索动作,每次持续约2 min。之后间断出现过数次全身抽搐发作,每次数分钟。近3个月出现一侧口角和/或上肢抽动一下(面-臂肌张力障碍性发作),每天数次发作,故来我院就诊。患者病程中曾至外院就诊,但均未予诊断和治疗。我院门诊查体发现近记忆力减退。仔细追问家属表明,患者除了上述癫痫发作,还有近记忆减退(忘记刚设置的存折密码)、脾气暴躁、睡眠障碍(白天思睡、睡眠中双手反复摸索动作等)。进一步复习外院2018年8月头部MRI,FLAIR序列显示已经可见双侧杏仁核高信号改变。综上,患者存在多种脑病临床表现,结合颞叶型癫痫发作尤其后期出现的面-臂肌张力障碍性发作以及影像学边缘系统受累,考虑要重点排查免疫性病因,遂送检血清筛查自身免疫性脑炎抗体,结果显示其中富亮氨酸胶质瘤失活蛋白1(Leucine-rich glioma inactivated-1,LGi1)抗体阳性,血生化显示钠水平低(119 mmol/L)。最终诊断LGi1脑炎,建议进行免疫治疗,但患者及家属拒绝免疫治疗,仅选择接受口服抗癫痫发作药物(Anti-seizure medications,ASMs)。
2 结果
分析上述3例患者诊疗经过,可以得出以下印象:① 目前,临床上对于表现反复癫痫发作的患者,存在送检自身免疫性抗体和启动免疫治疗的指征过于宽泛的情况。例1、2反映了这种倾向。例1因慢性反复癫痫发作就诊,但除了癫痫发作之外,并无脑病的其他表现,也没有影像学等辅助检查的支持,提示自身免疫性病因可能性不大,多次进行脑炎抗体筛查的做法并不合适。例2同样存在病史并未提示较强自身免疫性病因但多次送检抗体的情况,并且即使在多次抗体筛查均阴性的情况下,仍启动免疫治疗,有免疫治疗指征掌握过于宽松的嫌疑。例2的诊疗经过也提示,对于诊断抗体阴性的自身免疫性脑炎或癫痫一定要慎重,诊断之前首先要排除其他病因(如本例后期的代谢性脑病);② 如例3所示,癫痫发作通常不是自身免疫性脑炎的唯一表现。实际上,临床确诊为自身免疫性脑炎患者中,绝大多数患者还有脑病的其他表现,如记忆障碍、精神行为异常、睡眠障碍、运动障碍及植物神经紊乱等,这些症状有时表现轻微,不仔细问诊可能被漏掉。
3 讨论
从癫痫的诊疗难度看,本文前两个病例本身并不困难,但在诊疗过程中反映出一些值得关注的问题,即存在某种程度诊断“过度化”倾向,需引起注意,因为过度诊断往往导致过度治疗(如例2所示)。这不仅会造成医疗资源的浪费,也会给患者带来风险(如激素相关不良事件)。那么,该如何尽可能避免上述情况,我们认为应至少做到如下三点:
3.1 弄清相关概念的区别及意义
在2017年ILAE提出癫痫的六大病因中,免疫病因近些年尤其受到临床关注。相应地,这一领域出现了很多概念,例如,“免疫性癫痫”、“自身免疫性癫痫”、“自身免疫相关性癫痫”、“自身免疫性脑炎相关性癫痫”、“抗体阴性自身免疫性癫痫”、“自身免疫性发作”、“自身免疫性脑炎”、“自身免疫介导脑炎”“抗体阴性自身免疫性脑炎”等等。面对这些概念,不禁会让人产生疑惑:应该如何正确区分和使用?相关概念的提出是否必要及合理?
首先,就是要区分癫痫发作(痫性发作)与癫痫。简而言之,癫痫发作是一个症状学层面的概念,而癫痫则是一个疾病层面上的概念,癫痫是一种以反复出现癫痫发作为主要临床特征的慢性疾病。根据2014版ILAE癫痫实用性定义和2015年中国抗癫痫协会制定的《癫痫临床诊疗指南》中有关癫痫诊断的注意事项,患者的癫痫发作必须是“非诱发性”发作才能诊断为癫痫,而“诱发性”癫痫发作,如急性症状性发作(举例:热惊厥、脑卒中及脑炎的急性期痫性发作),即使反复出现也不诊断为癫痫。换言之,在疾病急性期出现的癫痫发作,只是疾病急性期的一个症状而已,不能将诊断上升为疾病(癫痫)层面 。一般而言,对于急性症状性发作,多数患者不发展成慢性癫痫状态,因此不需要长期服用ASMs;而对于诊断癫痫的患者,一般规律服用至少2~3年药物已是共识。混淆这两个概念,会造成临床上癫痫的过度诊断和ASMs过度使用。鉴于上述认识,对于自身免疫性脑炎中的痫性发作,由于尚处在炎症急性活动期,本质上属于“诱发性”痫性发作,应该将痫性发作看成自身免疫性脑炎的症状之一,不能也没有必要诊断为“自身免疫性癫痫”。只有当疾病到了没有明显炎症活动的慢性稳定期,此时临床若仍有反复痫性发作,才能考虑诊断为“自身免疫性癫痫”。不难理解,例2最初考虑为 “自身免疫性脑炎、自身免疫性癫痫”,这一诊断本身就存在语义上的自相矛盾,应避免类似的诊断。另外,尽管例3到我院就诊时病史已经长达1年半,但考虑到仍处于活动性炎症阶段,并且推测免疫治疗后大概率仍可获益,因此应该诊断为自身免疫性脑炎而非“自身免疫性癫痫”。需要注意的是,目前自身免疫性脑炎和“自身免疫性癫痫”的具体时间分界还是比较模糊的,尚无统一的标准,两者的区分更多是理论和概念层面上的,尚缺乏临床操作层面上的区分标准,这也是造成临床诊断混乱的原因之一。有学者建议,在自身免疫性脑炎1年后仍持续有癫痫发作时,才考虑诊断为自身免疫性癫痫。我们认为,鉴于不同抗体介导的脑炎的病程演变和预后差异较大,并且还受到是否及何时接受过免疫治疗的影响,确定一个固定的时间分界点来区分二者并不现实。
其次,要关注一个诊断称谓的变化,ILAE建议由“自身免疫性癫痫”变为“自身免疫相关性癫痫(Autoimmune-associated epilepsy)”。考虑到目前多数医生仍习惯使用前者,以下使用“自身免疫(相关)性癫痫”来体现这一术语转变。不难看出,术语转变旨在“弱化”免疫性(尤其抗体介导)机制在癫痫致病中的作用,理由在于:① 越来越多的证据显示,在慢性癫痫期,实际上免疫治疗效果往往不佳。推测可能的原因是,慢性期致痫机制主要是T细胞免疫毒性反应,而非神经元抗体直接介导所致。显然,这也提示将自身免疫性脑炎的治疗策略套用到“自身免疫(相关性)癫痫”中很可能并不合适;② 在慢性癫痫期,致痫机制除了潜在免疫因素外,可能还至少存在结构性异常因素(如海马硬化、神经胶质增生)。需要讨论的是,从癫痫治疗角度而言,考虑到免疫治疗在慢性癫痫阶段可能已经不占主要地位了,不免会让人质疑使用“自身免疫(相关性)癫痫”这一诊断术语的合理性和必要性。以Rasmussen脑炎为例, 目前人们认为“自身免疫”在致痫机制发挥作用,但免疫治疗效果通常不佳,而半球性手术治疗往往有效。因此,若将诊断称谓由“Rasmussen脑炎”改为“自身免疫性Rasmussen脑炎”并不合适,甚至有学者提出“Rasmussen综合征”的称谓可能更合适,因为“炎症”的病因暗示作用有可能导致免疫治疗的“过度”使用。上述考虑同样适用于免疫治疗效果不佳的抗谷氨酸脱羧酶65(Glutamic acid decarboxylase 65,GAD65)抗体阳性癫痫患者或肿瘤神经元抗体阳性癫痫患者。有“免疫因素”参与致病并不意味着一定要启动免疫治疗或免疫治疗一定有效。我们认为,仅根据慢性癫痫致病或致痫机制中有“免疫因素”参与,就将“自身免疫(相关)性”等字眼笼统地加在疾病诊断名称中的做法并不合适,有导致免疫治疗“过度化”的风险。
3.2 了解自身免疫性脑炎与“自身免疫(相关)性癫痫”的联系
基于目前认识,自身免疫性脑炎与“自身免疫(相关)性癫痫”的关系大体上可以用图1来理解。如图1所示,两者之间的界限并不清晰,不论是表型还是疾病时程上,都存在着交叉重叠。
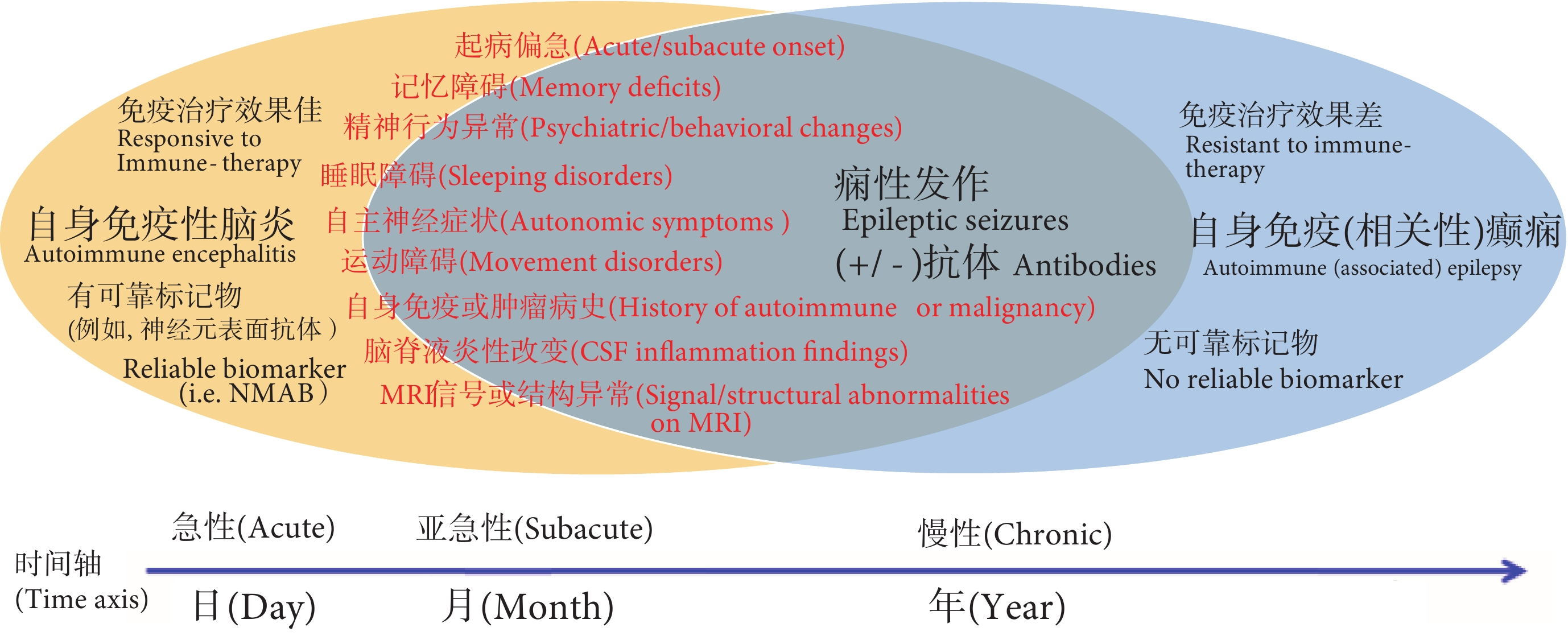
图1 自身免疫性脑炎与自身免疫(相关)性癫痫的关系
注:NMAB:神经元表面自身抗体;CSF:脑脊液;MRI:核磁共振成像;+/−:阳性/阴性
Figure1. The relationship between autoimmune encephalitis and autoimmune (associated) epilepsy
Notes: NMAB: neuronal membrane auto-antibodies; CSF: cerebral spinal fluid; MRI: magnetic resonance imaging; +/−: positive/negative
临床上,两者之间的联系大体分两种情况:① 部分患者先被诊断为自身免疫性脑炎,如抗N-甲基-D-天冬氨酸受体(N-Methyl-D-Aspartate receptors,NMDAR)脑炎、LGi1脑炎等。之后逐渐转为慢性癫痫状态,即进入所谓的“自身免疫(相关)性癫痫”的阶段。在急性期,痫性发作的发生率及具体类型因病因(特异性抗体)不同而存在差异。绝大多数情况下,痫性发作仅是急性期众多临床症状之一,痫性发作作为自身免疫性脑炎的唯一临床症状的情况是很少见的。目前研究显示,抗神经元表面抗原抗体介导自身免疫性脑炎的最终转成慢性癫痫状态的患者比例较低(可能不超过10%);② 部分患者主要因为慢性反复痫性发作就诊,进行抗体等免疫学检查,结果提示病因学中有 “免疫因素”参与,例如特异性抗体阳性,进而诊断为“自身免疫(相关)性癫痫”。临床上,这种情况的患者又可大致分成两种:a. 部分患者除了有痫性发作之外,往往还有脑病的其它表现,如记忆力下降、精神行为异常、意识障碍、植物神经功能异常、运动障碍或睡眠障碍等。只不过由于这些症状可能轻微或不明显,家属和患者往往并不主动提供,而更多关注了痫性发作。本文例3就是这种情况,提示临床医生应该仔细全面询问病史和查体。不难理解,若还有其他辅助检查(如脑脊液、MRI等)也支持有活动性炎症证据,尤其尚未接受过免疫治疗,则提示这类患者实际上仍处于自身免疫性脑炎阶段,而不应诊断为“自身免疫(相关性)癫痫”。对于这类患者,仍有必要启动免疫治疗,例3就属于这种情况;b. 少数患者临床除了痫性发作之外,确实无或至少无明显的其他脑病表现,辅助检查也未提示活动性免疫炎症的证据,这类患者似乎符合“自身免疫(相关性)癫痫”状态。不过,这类患者中发现相关抗体的比例并不高且抗体的临床意义也存在争议。近期一项对以往数据进行汇总分析的研究显示, 在排除了自身免疫性脑炎或急性症状性发作后,在慢性癫痫(主要是局灶性癫痫)患者中,发现有致痫意义的抗体比例仅为5.9%。另有研究显示,在拟行手术治疗的病因不明难治性局灶性癫痫患者中,中枢神经系统特异性抗体阳性的比例也仅为8.14%。这些研究提示,尽管ILAE将“免疫病因”作为6大病因之一单独提出,所谓的“自身免疫(相关性)癫痫”在总的癫痫患者群中所占比例可能并不大。此外,尤其值得进一步关注的是,对于慢性癫痫状态患者,在发现了传统上认为有致病意义的神经元表面抗原抗体(如NMDAR抗体、LGi1抗体等)之后,即使不启动免疫治疗其长期预后也较好,甚至要好于那些接受免疫治疗的患者。上述研究结果对相关抗体在慢性癫痫患者致痫机制中是否以及在多大程度上发挥了作用提出了质疑。我们认为,观察抗体阳性慢性癫痫患者在免疫治疗后长期发作预后的前瞻性研究有助于回答这些疑问。
3.3 合理利用相关量表,在“及时正确”和“过度”诊疗之间找到最佳平衡点
自身免疫性脑炎和“自身免疫(相关)性癫痫”的患者均可能以痫性发作为主要临床表现就诊,而两者之间又缺乏统一明确的区分标准,使得临床诊疗面临较大的困惑和挑战。一方面,正确诊断并及时启动免疫治疗是自身免疫性脑炎预后的重要影响因素。大量临床病例已经证实,早期免疫治疗是有效改善难治性痫性发作预后的主要手段。另一方面,正如本文例1和2所示,也要尽可能避免诊疗“过度化”。总体而言,对于所有新发痫性发作患者不加选择地进行抗体筛查并不合适,这会造成医疗资源浪费和患者家庭经济负担的增加。因此,如何平衡好上述两方面考虑,是每个临床医生都要面对的问题。近些年来,国外学者提出了一些临床相关预测量表,试图回答诸如“是否应该送检抗体以及是否应该启动免疫治疗”等重要问题,可供临床参考使用。在诊断方面,如果临床判断倾向于自身免疫性脑炎,推荐APE(Antibody prevalence in epilepsy)2量表,该量表共10个评分项,总分18分。若评分≥4,则预测特异性抗体阳性的敏感性为98%,特异性85%。若临床判断倾向于慢性癫痫状态,即考虑“自身免疫(相关)性癫痫”时,推荐使用ACES(Antibodies contributing to focal epilepsy signs and symptoms)量表,此量表简单且容易操作,仅有6个评分项,总分6分。如果评分≥2,则预测特异性抗体阳性的敏感性为100%,特异性85%。对于怀疑“免疫病因”的痫性发作患者,有学者建议联合使用APE2和ACES量表:对于APE2评分≥4患者,以及APE2评分结果≤3且ACES评分≥2的患者,均应送检相关抗体。对于拟行术前评估的不明原因局灶性癫痫患者,推荐使用APES(Antibody prevalence in epilepsy before surgery)量表。 在是否启动免疫治疗方面,可参考RITE(Response to immunotherapy in epilepsy)量表,本量表有11个评分项,共19分。如果评分≥7,则预测免疫治疗后发作预后良好的敏感性为88%,特异性84%。
套用上述量表,本文3例病例的ACES评分为0、0、3分;APE2评分为0、3、7分;RITE评分为0、3、7分。提示支持例1和2送检抗体和启动免疫治疗的力度均不强,而例3的情况正相反,均与我们最初的临床判断相一致。当然,这些量表的实用性和有效性仍有待于更多临床实践来检验,尤其在儿童患者、不同类型抗体及不同族群患者中的研究数据还较少。不难理解,使用上述量表必然存在“假阳性”和“假阴性”病例,发生率取决于评分截点的设定、临床是否同时送检脑脊液等因素。实际上,临床实际情况往往比较复杂,诸如抗体阴性或临床表现不太支持“免疫病因”,但试验性免疫治疗有效的个案时有所见。因此,本文所反映的诊疗“过度化”是相对意义上的,在临床中是难以绝对避免的!
综上,自身免疫和痫性发作的关系密切且复杂。目前,自身免疫性脑炎已被广大临床医生所接受,由包括痫性发作在内的不同表征组成的临床上可识别的“疾病实体/综合征”,如NMDA受体脑炎、LGi1脑炎等,也已被大家认可,相关诊断标准和治疗方案也日趋明朗。形成鲜明对比的是,“自身免疫(相关)性癫痫”仍处于一种概念意义上的存在。由于缺乏特异性指标(biomarker),同时也尚无一个成型的、可供临床识别的、具有特定表型的“疾病实体/综合征”,目前临床上诊断及治疗“自身免疫(相关)性癫痫”仍有较大难度。因此,在现阶段,“自身免疫(相关)性癫痫”在临床诊疗中不宜扩大化使用 。此外,“自身免疫(相关)性癫痫”这一名称的适当性及合理性也有待商榷。上述临床诊疗困境的解决,尚有待于更深入的有关各种抗体及先天免疫标记物(如细胞因子、趋化因子)的致痫机制、相关分子及形态病理学、以及更多临床病例,尤其是各种免疫治疗的长期预后等方面的研究。现阶段,作为权宜之计,临床合理使用相关预测量表可能会在一定程度上减少诊疗“过度化”。
上一篇 : 儿童癫痫发病危险因素的Meta分析_《癫痫杂志》
下一篇:暂无
备案号:渝ICP备2022007412号-1

